水の特性:同位体と分子構造。
水の同位体組成
水は、核内のプロトンに関連する中性子の数が互いに異なる、酸素と水素の同位体のさまざまな組み合わせの混合物です。
1H,2 H(重水素)3H(トリチウム)
16O, 17O,18O.
同位体の関係は次のとおりです。
水素の場合:
2H/1H = 1 / 6900
3H/1H = 1 / 10 18
トリチウムは不安定な元素であり、その半減期は12,5年です。
酸素の場合:
18O/16O = 1 / 500
17O/16O = 1 / 2500
主な4分子種とその頻度は次のとおりです。
1H216O = 99,7%
1H2 18 O = 0,2%
1H217O = 0,04%
1HD16O = 0,03%
D216O =非常に弱い
異なる同位体は、分子の物理的性質、特に密度に違いを引き起こしますが、化学的性質は同じままです。
ヘビーウォーターD2Oは自然な状態で存在しますが、非常に
低。 かなりの量を得るには、同位体分離の技術を習得する必要があります。これは、原子兵器を準備するための最後の世界大戦中の基本的な課題のXNUMXつでした。
水の化学成分の同位体組成は、温度などの熱力学的パラメータの推定に使用されます。
レポート 18 O/16O 極地の帽子からの氷と化石地下水からの水は、過去の気候に関する情報を提供します。
海水の蒸発は同位体分別で起こります:酸素の軽い同位体は好ましくは重い同位体に蒸発します。 海は雲や降水からの水よりも重い同位体が豊富です。
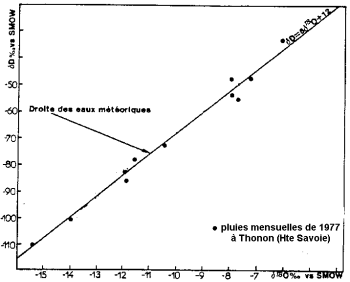
沈殿物の安定した同位体含有量(Blavoux and Letolle、1995年以降)。
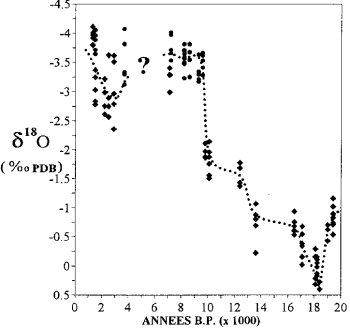
マヨッテのサンゴの酸素同位体含有量の変動(Casanova et al。、1994の後)。
分子の構造
水素原子と酸素原子は電子をプールして、ネオンのような完全な層を形成します。 確かに、酸素原子はその電子シェルを完成させるために2つの電子を欠いており、それを提供するのは2つの水素原子です。 形成されたH2O分子は安定しています。
酸素:8陽子+ 8中性子
水素:2(2 *(1陽子+ 1中性子))
合計:10電子の電荷のバランスをとる10陽子。
水素核は酸素の片側を持ち、特徴的な「ミッキーの頭」(水素は耳)を形成します。
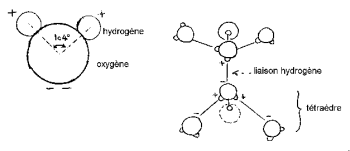
HOH角度は104,474°(四面体形状の特徴)です。 酸素と水素原子の間の距離は、蒸気中で1 A°(0,95718 A°)に近いです。 分子の有効直径は2,82A°のオーダーです。
この小さな分子には電荷が不均一に分布しています。 電子は水素原子よりも酸素原子に強く引き付けられます。 水素核の近くに2つの正電荷の中心があり、酸素核の近くに2つの負電荷の中心があります。 水分子の非線形形状と組み合わされた電荷分布のこの不均衡は、強い電気双極子モーメントの存在として現れます。 水分子は極性があります。 電気双極子のように動作するため、他の極性分子と結合できます。 確かに、水分子は、反対の電荷のそれらの部分をそれらに向けることによって、結晶の構成イオンの間に挿入することができます。 結晶性イオンの引力が大幅に弱まり、結晶の凝集力が低下し、溶解が促進されます。 水分子の極性特性は、マイクロ波加熱の技術を説明しています。 確かに、分極した分子は、電界に関連してそれ自体を配向します。 これが変化すると、分子は配向の変化に従います。 水の場合は数GHzの特定の周波数から、分子の動きが摩擦によって熱を発生します。 家庭用オーブンは通常、UHFである2,45GHzの周波数で動作します。
分子の3つの核は静止しておらず、互いに対して移動し、分子は振動してねじれます。 液体の水では、分子が結合する傾向があります。ミッキーの頭は水素結合によって耳と顎を結合します。 実際、酸素の8つの周辺電子のうち、水素原子との共有結合に関与しているのは4つだけです。 残りの4つの電子は、自由電子ダブレットと呼ばれる2つのペアにグループ化されます。 これらの負に帯電したダブレットのそれぞれは、近くの水分子の正に帯電した水素原子と静電結合を形成することができます。 それにもかかわらず、室温で安定している水素結合は、共有結合と比較して壊れやすい。 水分子では、2つの共有結合と2つの自由電子ダブレットの方向によって形成される形状は、中心が酸素核によって占められている四面体の形状に近いです。
しかし、水分子の大規模な構造はまだ完全にはわかっていません。 X線および中性子回折スペクトルは2つの主要な値を提供します:1 A°に対応する信号、水素と酸素の核間の距離、および温度と温度に応じて変化する2,84〜4A°の値2つの酸素核間の距離に対応します。 RX回折法では、特定の分子から距離Rにある液体の単位体積あたりの平均分子数を知ることもできます。 水分子には平均4,4個の隣接物があり、これは四面体メッシュを示唆しています。 水素結合によって連結された分子に加えて、他の非結合分子があります。これは、隣接する分子の数が4よりわずかに多く、厳密な四面体結晶化状態で必要とされる4ではない理由を説明している可能性があります。 水素結合によって連結された分子の結晶格子は、結合していない分子が収容される空洞を形成します。 別の仮説は、水素結合の歪みに基づいています。 後者は元々線形であり、つまりO – HO原子が整列しているため、さまざまな程度にねじれ、隣接する分子よりも離れた分子が中央の分子に近づくことができます。
最近、強力なコンピューターを使用して理論モデルが開発されました。 それらは、水分子の約80%が3つまたは4つの水素結合に関与していることを示しています。 一方、それらは非結合分子の存在を除外します。 コンピューターモデリングは、水が冷えるにつれて、分子のネットワークが氷の場合と同様の六角形にますます似ていることを示唆しています。
固体状態は、より厳密な結晶配列に対応します。 常圧では、氷は六角形の構造をしています。 低温(-80°C未満)では、立方体の構造をとることができます。 電荷は結晶格子内を移動し、イオン型の結晶欠陥(水和プロトンH3O +およびヒドロキシルイオンOH-)を生成する可能性があります。 氷の結晶格子は、可能な限り最もコンパクトな分子の積み重ねに対応していません。 融合すると、水素結合が壊れて分子が互いに近づくため、欠陥が崩壊します。密度は4°Cで最大になります。 続いて、液体の水中では、温度の上昇により分子が押し離され、密度が低下します。
詳細、参考文献、および参考文献:
Blavoux B. and Letolle R.(1995)-地下水の知識への同位体技術の貢献。 地質年代学、54、p。 12-15。
Caro P.(1990)-水の物理的および化学的性質。 水の偉大な本、ラ・ヴィレット、p。 183-194。
Eagland D.(1990)-水の構造。 La Recherche、221、p。 548-552。
Maidment DR(1992)-水文地質学のハンドブック。 マクグラウヒル。
Casanova J.、ColonnaM。およびDjerroudK。(1994)-Geoprospective-古気候学。 ラップ。 科学者。 BRGM、p。 76-79。

